1.1 核内受容体とは何か?
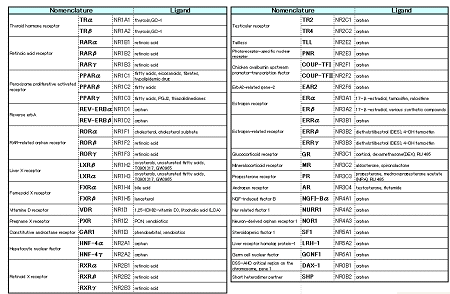
核内受容体Nuclear Receptorsは、生体分子としての構造と作用機序に共通性が見られるという意味で、Superfamilyをなす一群のタンパク質である。核内受容体は、多細胞動物Metazoansに存在する転写制御因子で、進化の過程でよく保存され、発生や形態形成に関与している。ヒトでは48種が知られ、同じ哺乳類のマウスではそれより一つ多い49種が知られている。
| ヒトの48種類のNRs |
 |
核内受容体は、個性的な領域、DNA結合領域、リガンド結合領域という3つの領域から構成されている。
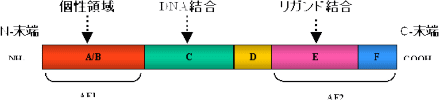 |
| 核内受容体Superfamailyの構造:共通性あり |
リガンドが結合すると、リガンド結合した同じ核内受容体とHomodimerを結成するかして、応答配列response elementと呼ばれるDNAの特徴的な配列に結合し、さまざまな遺伝子(標的遺伝子)の発現を促進activateするか、抑制repressする。
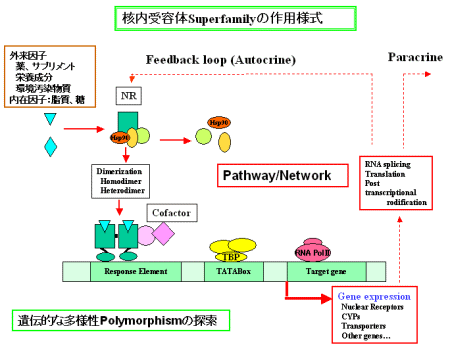 |
ヒトの核内受容体は、さまざまな生理作用に関与し、内分泌疾患、代謝疾患、がんなどの疾患に関与していることが知られているが、最近は、神経疾患や加齢Agingとの関係も研究されている。核内受容体がこれほど多くの生命現象や疾患現象に関与していることが認識されるようになったのは、比較的最近のことであり、とくにヒトゲノム解読計画が終盤に近づいた1990年代の後半からである。
核内受容体の遺伝子が最初にクローニングされたのは、1985年のGlucocorticoid Receptor GRであり、当時はステロイドホルモンSteroid Hormoneや甲状腺ホルモンThyroid Hormone、あるいはビタミンD3などの受容体として、内分泌系Endocrine Systemに関与する転写調節に関わる因子と認識されていた。内分泌ホルモン受容体としての核内受容体に関しては、ホルモンに詳しいTataの総説(Tata02)がある。
| ・ | *J. R. Tata, Signalling through nuclear receptors, Nature Reviews, Molecular Cell Biology, Vol. 3, Sept. 2002, pp.702-711 |
こうしたイメージが大きく変わったのは、リガンドが不明でOrphan Receptorと呼ばれていたPPAR, LXR, RXR,・・・など一群の核内受容体がSterolのような脂質分子と結合し、それらの代謝に関与していることが発見されてからのことである。ホルモン受容体としての核内受容体もリガンドであるホルモンが結合するとhomodimerあるいはhetordimerを形成してDNAの特定の領域(response element)に結合し、転写を制御するが、リガンドが結合したOrphan核内受容体も複合体を形成して、DNAのresponse elementに結合する。こうした複合体形成で重要な対となる核内受容体がRXR (Retinoid X Receptor)である。 GRのクローニングに成功したのはRonald Evansであったが、RXRのクローニングを行ったのは、Pierre Chambonのグループであった。この他にも、EvansとChambonのグループは、核内受容体研究で多くの成果をあげてきた。2005年のMolecular Endocrinology誌には、この2人の回想録が掲載されている(Evans05, Chambon,05)。核内受容体研究の歴史を手っ取り早く知る上でこの2つの回想録は最良の情報であろう。なお、核内受容体の基本的な作用機序を解明することに大きく寄与したのがEvans研に留学していたが故人なられた、K. Umesono博士である(Umesono89)。
| ・ |
*Ronald M. Evans, PPARs and the complex journey to obesity, The Keio Journal of Medicine, Vol. 53 (2004) , No. 2 June pp.53-58. http://www.jstage.jst.go.jp/article/kjm/53/2/53_53/_article |
| ・ | Ronald M. Evans, The Nuclear Receptor Superfamily: A Rosetta Stone for Physiology, Molecular Endocrinology 19 (6): 1429-1438、2005. |
| ・ | Pierre Chambon, The Nuclear Receptor Superfamily: A Personal Retrospect on the First Two Decades, Molecular Endocrinology 19(6):1418-1428, 2005 |
| ・ | K. Umesono, R.M. Evans, Determinants of target gene specificity for steroid/thyroid hormone receptors. Cell 57:1139-1146, 1989. |
ヒトの核内受容体が48ということが決定されたのは、1990年代の末であるが、ヒトゲノム解読の結果もこの結論を変えていない。この48の中には、リガンドがいまだ未知なもの、リガンドが結合して複合体を形成してDNAの特定の領域に結合するという、核内受容体の特徴に反しているものも含まれている。他のタンパク質群がそうであるように、核内受容体も発見の過程で名称には重複があった。現在では、名称委員会Nomenclature Committeeによって、配列を基礎にした名称の整理統一が行われている。
1.2 現状の知識 Present Knowledge Summary
核内受容体に関する知識の現状を知るには、International Union of Pharmacology (IUPHAR)が作成した総説シリーズが参考になる。これらの総説では、個々の核内受容体の構造や機能の特徴がグループごとに詳述されている。
| ・ | *Special Issue IUPHAR Compendium of the Pharmacology and Classification
of the Nuclear Receptor Superfamily 2006 (http://pharmrev.aspetjournals.org/content/vol58/issue4/) |
| ・ | Pierre Germain, Bart Staels, Catherine Dacquet, Michael Spedding, and Vincent
Laudet, Overview of Nomenclature of Nuclear Receptors, Pharmacol Rev 2006
58: 685-704 (http://pharmrev.aspetjournals.org/cgi/reprint/58/4/685) |
| ・ | *Frederic Flamant, John D. Baxter, Douglas Forrest, Samuel Refetoff, Herbert Samuels, Tom S. Scanlan, Bjorn Vennstrom, and Jacques Samarut , International Union of Pharmacology. LIX. The Pharmacology and Classification of the Nuclear Receptor Superfamily: Thyroid Hormone Receptors, Pharmacol Rev 2006 58: 705-711, (http://pharmrev.aspetjournals.org/cgi/reprint/58/4/705) |
| ・ | *Pierre Germain, Pierre Chambon, Gregor Eichele, Ronald M. Evans, Mitchell A. Lazar, Mark Leid, Angel R. De Lera, Reuben Lotan, David J. Mangelsdorf, and Hinrich Gronemeyer, International Union of Pharmacology. LX. Retinoic Acid Receptors, Pharmacol Rev 2006 58: 712-725. (http://pharmrev.aspetjournals.org/cgi/reprint/58/4/712) |
| ・ | *Liliane Michalik, Johan Auwerx, Joel P. Berger, V. Krishna Chatterjee, Christopher K. Glass, Frank J. Gonzalez, Paul A. Grimaldi, Takashi Kadowaki, Mitchell A. Lazar, Stephen O'Rahilly, Colin N. A. Palmer, Jorge Plutzky, Janardan K. Reddy, Bruce M. Spiegelman, Bart Staels, and Walter Wahli, International Union of Pharmacology. LXI. Peroxisome Proliferator-Activated Receptors, Pharmacol Rev 2006 58: 726-741. (http://pharmrev.aspetjournals.org/cgi/reprint/58/4/726) |
| ・ | *Pierre Germain, Pierre Chambon, Gregor Eichele, Ronald M. Evans, Mitchell A. Lazar, Mark Leid, Angel R. De Lera, Reuben Lotan, David J. Mangelsdorf, and Hinrich Gronemeyer, International Union of Pharmacology. LXIII. Retinoid X Receptors Pharmacol Rev 2006 58: 760-772. (http://pharmrev.aspetjournals.org/cgi/reprint/58/4/760) |
| ・ |
*Karin Dahlman-Wright, Vincent Cavailles, Suzanne A. Fuqua, V. Craig Jordan, John A. Katzenellenbogen, Kenneth S. Korach, Adriana Maggi, Masami Muramatsu, Malcolm G. Parker, and Jan-Ake Gustafsson, International Union of Pharmacology. LXIV. Estrogen Receptors, Pharmacol Rev 2006 58: 773-781. (http://pharmrev.aspetjournals.org/cgi/reprint/58/4/773) |
| ・ |
*Nick Z. Lu, Suzanne E. Wardell, Kerry L. Burnstein, Donald Defranco, Peter J. Fuller, Vincent Giguere, Richard B. Hochberg, Lorraine McKay, Jack-Michel Renoir, Nancy L. Weigel, Elizabeth M. Wilson, Donald P. McDonnell and John A. Cidlowski, International Union of Pharmacology. LXV. The Pharmacology and Classification of the Nuclear Receptor Superfamily: Glucocorticoid, Mineralocorticoid, Progesterone, and Androgen Receptors, Pharmacol Rev 58:782-797, 2006 (http://pharmrev.aspetjournals.org/cgi/content/full/58/4/782) |
| ・ |
*Gerard Benoit, Austin Cooney, Vincent Giguere, Holly Ingraham, Mitch Lazar, George Muscat, Thomas Perlmann, Jean-Paul Renaud, John Schwabe, Frances Sladek, Ming-Jer Tsai, and Vincent Laudet, International Union of Pharmacology. LXVI. Orphan Nuclear Receptors, Pharmacol Rev 2006 58: 798-836 (http://pharmrev.aspetjournals.org/cgi/reprint/58/4/798) |
1.3 共役因子 Coregulator
転写因子Transcription Factor (TF) である核内受容体は、遺伝子発現を調節(制御)する。調節される側の遺伝子をその核内受容体の標的遺伝子Target Geneと呼ぶ。一般に、転写因子の標的遺伝子を網羅的にしらべることは、ヒトゲノム解読後のゲノム研究の重要な仕事になっているが、それが完全に決定された転写因子はまだない。遺伝子発現は、細胞が所属する組織と置かれた環境、さらに細胞内の状況に依存した、極めてダイナッミクな現象である。
転写には、どの組織においても動員される基本的な分子群と、状況に応じて動員される副次的な分子群の2つが関係している。前者の構成は同じであるが、後者は状況において組み合わせが異なる。さらに最近の研究では、動員されている分子群の個々の分子の状態が、例えばリン酸化されているとか、アセチル化されている、というように、翻訳後の修飾を受けていることが判明してきた。つまり、転写を制御する複合体を構成する要素は組織特異的に組み変わる。そうした転写を制御するDNAと相互作用する複合体は、時間と共に生成されたり、分解されたりする。さらに、複合体を構成している分子の状態も状況によってダイナミックに変化するのである。後者は、エピジェネティックepigeneticな現象である。
共役因子には、そうした因子が結合することによって転写が行われるものActivatorと転写が抑制されるものRepressorとがある。そうした共役因子の数は、数百を越えていると予測されており、わかっているものはデータベースに収められている。共役因子に関する報告は増え続けているが、比較的新しい総説はV. Perissi & M. G. Rosenfeldのそれ(Perissi05)である。
核内受容体の共役因子は疾患にも関係している。これについては、総説があり(Lonard07)、また単行本も出版されている(Lanz08)。
| ・ | *Cosma MP (2002) Ordered recruitment: gene-specific mechanism of transcription activation. Mol Cell 10: 227-236 |
| ・ | *Hermanson O, Glass CK, and Rosenfeld MG (2002) Nuclear receptor coregulators: multiple modes of modification. Trends Endocrinol Metab 13: 55-60 |
| ・ | *Kraus WL and Wong J (2002) Nuclear receptor-dependent transcription with chromatin: is it all about enzymes? Eur J Biochem 269: 2275-2283. |
| ・ | *Privalsky ML (2004) The role of corepressors in transcriptional regulation by nuclear hormone receptors. Annu Rev Physiol 66: 315-360 |
| ・ | Smith CL, Nawaz Z, and O'Malley BW (1997) Coactivator and corepressor regulation of the agonist/antagonist activity of the mixed antiestrogen, 4-hydroxytamoxifen. Mol Endocrinol 11: 657-666 |
| ・ | *Perissi V, Staszewski LM, McInerney EM, Kurokawa R, Krones A, Rose DW, Lambert MH, Milburn MV, Glass CK, and Rosenfeld MG (1999) Molecular determinants of nuclear receptor-corepressor interaction. Genes Dev 13: 3198-3208 |
| ・ | *Liu XF and Bagchi MK (2004) Recruitment of distinct chromatin-modifying complexes by tamoxifen-complexed estrogen receptor at natural target gene promoters in vivo. J Biol Chem 279: 15050-15058 |
| ・ | Smith CL and O'Malley BW (2004) Coregulator function: a key to understanding tissue specificity of selective receptor odulators. Endocr Rev 25: 45-71 |
| ・ | *Perissi V and Rosenfeld MG (2005) Controlling nuclear receptors: the circular logic of cofactor cycles. Nat Rev Mol Cell Biol 6: 542-554 |
| ・ | *Pascual G, Fong AL, Ogawa S, Gamliel A, Li AC, Perissi V, Rose DW, Willson TM, Rosenfeld MG, and Glass CK (2005) A SUMOylation-dependent pathway mediates transrepression of inflammatory response genes by PPAR- . Nature (Lond) 437: 759-763 |
| ・ | D. M. Lonard, R. B. Lanz, B. W. O'Malley, Nuclear Receptor Coregulators and Human Disease, Endocrine Reviews, 28(5): 575-587, 2007. |
| ・ | R. B. Lanz, D. M. Lonard, B. W. O'Malley, Nuclear Receptor Coregulators in Human Diseases, In: Nuclear Receptor Coregulators and Human Diseases, eds Kumar R and O'Malley BW. World Scientific, pp1-133, 2008. |
1.4 核内受容体による遺伝子発現制御 Gene Expression
ゲノム解読データが得られたことにより、転写因子としての核内受容体がゲノム全体にわったってどのような作用しているかが関心を惹いている。これは核内受容体が調節する個々の遺伝子ごとに詳細にしらべる必要がある。核内受容体は他の転写因子、例えばactivator protein 1 (AP-1), Sp1, FOXA1などと一緒にDNAのプロモータ領域に結合する。これらの因子が結合するDNAの位置や、それによってmRNAが転写される(遺伝子の)領域などのゲノム全体にわたる決定作業が進んでいる。その現状はKininis08に要約されている。
| ・ | M. Kininis and W. Kraus, A global view of transcriptional regulation by nuclear receptors: gene expression, factor localization, and DNA sequence analysis. Nucl Recept Signal 6, e005, 2008 |
1.5 進化から見た核内受容体 Evolutional View of Nuclear Receptor Superfamily
核内受容体は、後生動物(多細胞動物)Metazoanにのみ存在するとされている。多細胞動物のゲノムが解読されると、核内受容体の数が報告されるようになった。例えば、線虫では270以上、ハエ(ショウジョウバエ)が18、フグが68、ミツバチが24などと報告されている。線虫で異常に多いのは、特定の種HNF4に大きな重複が起きたからだと考えられている。これらの核内受容体は、その動物の発生に関与している。後生動物では、発生に関与する経路として、RTK, Wnt, Hh, TGF-β, Notch, Jak/STAT, および核内受容体のそれが、種を越えて共通に保存されていることが知られているが、保存されているのは実は、経路だけでなくそれらの経路への信号分子(リガンド)、受容体、DNAの応答配列、標的遺伝子などである。すなわち経路と転写機構とその産物まで広く保存されることが比較ゲノム学の成果としてわかってきた。
転写因子および転写機構は、ゲノム解読後の生物学の大きな挑戦課題として浮上してきた。それはRNAi現象の発見や、non-coding RNAの発見など、高等生物を特徴づける遺伝子発現機構の複雑さに関係した問題であるが、転写因子である核内受容体は、この問題のよい課題例になってきている。
| ・ | K.J. Peterson, E.H. Davidson,Regulatory evolution and the origin of the bilaterians, PNAS, 97(9): 4430-4433,2000 |
| ・ | Dirk A. Kleinjan and Veronica van Heyningen、Long-Range Control of Gene Expression: Emerging Mechanisms and Disruption in Disease, Am. J. Hum. Genet. 76:8-32, 2005 |
| ・ | B J Swalla, Building divergent body plans with similar genetic pathways, Heredity 97, 235-243, 2006 |
| ・ | H. Escriva, F. Delaunay, and V. Laudet, Ligand binding and nuclear receptor evolution, BioEssays 22:717-727, 2000 |
| ・ | *Owen GI and Zelent A, Origins and evolutionary diversification of the nuclear receptor superfamily. Cell Mol Life Sci 57: 809-827, 2000. |
| ・ | MICHAEL E. BAKER, Xenobiotics and the Evolution of Multicellular Animals: Emergence and Diversification of Ligand-Activated Transcription Factors, INTEGR. COMP. BIOL., 45:172-178 (2005) |
核内受容体がどれだけ原始的な後生動物まで存在するかは、後生動物の起源を推定することにも通ずる興味深い問題である。最近、単細胞の真核生物と後生動物との境界に位置するような、スポンジや立襟べん毛虫までのゲノム解読が行われたことは、こうした問題にヒントを与えるものであると期待される。また最近は、酵母に核内受容体に似た転写因子が、その共役因子と対応して存在することが発見された(Thakur08)た。この転写因子が、多剤耐性multidrug resistanceに関係したTransporterを誘導するものであることも興味深い。これは進化における共役関係をCo-opt示す例と考えられている。
| ・ | J. K. Thakur et al., A nuclear receptor-like pathway regulating multidrug resistance in fungi, Nature, 452(3): 604-609, 2008. |
1.6 転写を介した代謝制御 Transcriptional Regulation of Metabolism
転写を介した代謝制御は、核内受容体とメタボリック症候群を関連づける分子機構である。その重要さを指摘したのは、Opening the X-Files,というしゃれた副題をつけたMangelsdorf,らの論文(Chawla01)である。この"X-Files"は、Metabolic SyndromeがMetabolic Syndrome X, あるいはSyndrome Xと呼ばれていることと、人気テレビ番組、X-Filesを引っ掛けたものであろうと思われる。この分子機構をさらに詳しく解説しているのが、Desvergneらの論文(Desvergne06)である。
| ・ | *Ajay Chawla, Joyce J. Repa, Ronald M. Evans, David J. Mangelsdorf, Nuclear Receptors and Lipid Physiology: Opening the X-Files, SCIENCE, VOL 294: 1866-1870, 2001. |
| ・ |
*Beatrice Desvergne, Liliane Michalik and Walter Wahli, Transcriptional
Regulation of Metabolism, Physiol. Rev. 86: 465-514, 2006; (http://physrev.physiology.org/cgi/reprint/86/2/465) |
そのエッセンスは、この論文の図(FIG 11)である。
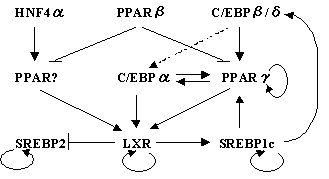 |
| Beatrice Desvergne, Liliane Michalik and Walter Wahli, Transcriptional Regulation of Metabolism, Physiol. Rev. 86: 465-514, 2006; の図(FIG 11)より改編。 |
この図にあるように、転写を介した代謝の制御には,かつてOrphan Receptorと呼ばれた脂質代謝に関わる核内受容体とその親戚ともいえるような、エネルギー(物質)代謝に関わっている転写因子、C/EBPやSREBPが関与していることがわかる。
1.7 核内受容体と薬物代謝酵素と生体防御機構
核内受容体は、ホルモン補充療法 Hormone Replacement Therapy、乳がんや前立腺がん、糖尿病など、特定の疾患の薬物治療の標的として重要である。それゆえ、これらの疾患や標的を研究しているMedicinal Chemistsが、核内受容体に関心をもつのは当然にことであろう。しかし核内受容体はこうした治療標的を研究していないMedicinal Chemistsにとっても、関心をもっておかねばならない生体分子である。その理由は、核内受容体がCYP (Cytochrome P-450)など、薬物代謝酵素の多くを誘導するからである。薬物代謝酵素、とくにCYPは酸素添加酵素Monooxigenaseとして半世紀以前から知られており、薬理学者によって研究されてきた。現在、薬物代謝酵素は、CYP以外に、GSTのような抱合酵素、Transporterが知られており、それらはPhase I, Phase II, Phase III酵素と呼ばれることもある。こうした薬物代謝酵素を誘導する転写因子がAhR、核内受容体、Nrf2であることが発見されたのは、比較的最近のことである。例えば環境汚染物質としてよく知られているダイオキシンDioxinsの受容体であるAhRは、核内受容体と同じように、脂質のリガンド(ダイオキシン)が結合すると、もうひとつのタンパク質Arntと複合体を形成して、DNAの特定の配列領域(AhR response element)に結合して標的遺伝子の転写を起こすが、その中にはCYP1A1が含まれている。核内受容体であるPXR(ヒトではSXRと呼ばれることもある)は、CYP3A4の転写を促す。酸化ストレス応答因子と考えられているNrf2も、同じような仕組みでGST、NQO1, GCSなどのPhase II酵素の転写を引き起こす。これらは全体として内在的な、あるいは体に入ってきた外からの化合物を代謝し、生体を防御Detoxificationする機構を構成していると考えられるようになってきた。薬物代謝酵素CYP3A4は、現在市場に出ている薬の6割程度を代謝すると考えられているから、薬の相互作用を避けようとするなら、新薬をデザインする際、CYP3A4との結合を避けるようにすべきであるとも考えられるようになってきた。この意味で、PXR/SXRは一般的な反標的Anti-targetと認識されるようになってきている。PXR/SXRがCYP3A4を誘導することや、Nrf2が発見されたのは比較的最近のことであるから、こうした生体防御機構や反標的などの概念もまだ十分に普及していない状況にある。
核内受容体のこのような側面は、Medicinal Chemistsにとって必須の基盤知識になってきていると言えよう。
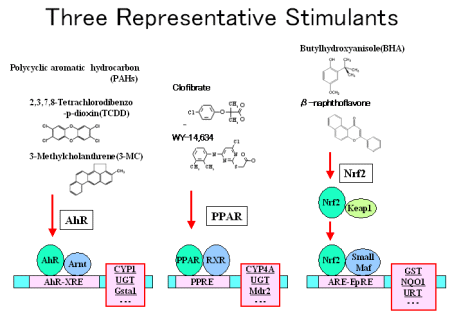 |
| ・ | Timothy M.Willson and Steven A. Kliewer, PXR, CAR AND DRUG METABOLISM, Nature Reviews , 1: 259-266, 2002. |
| ・ | Sean Ekins, Leonid Mirny, and Erin G. Schuetz, A Ligand-Based Approach to Understanding Selectivity of Nuclear Hormone Receptors PXR, CAR, FXR, LXRα,and LXRβ, Pharmaceutical Research, 19, 1788-1800(2002) |
| ・ | A. B. Okey, ,An Aryl Hydrocarbon Receptor Odyssey to the Shores of Toxicology: The Deichmann Lecture, Toxicol. Sci. 98:5-38, 2007. |
| ・ | Thomas M Magin, A keaper and a striker maintain epidermal homeostasis, Nature Genetics 35, 202 - 204 , 2003 |
| ・ | Zheng Sun, Shirley Zhang, Jefferson Y. Chan, and Donna D. Zhang, Keap1 Controls Postinduction Repression of the Nrf2-Mediated Antioxidant Response by Escorting Nuclear Export of Nrf2, Mol Cell Biol., 27(18): 6334-6349, 2007. |
1.8 おわりに:生物医学と創薬における核内受容体研究の意義 Significance of Nuclear Receptor Research in Biomedicine and Drug Discovery
ヒトの核内受容体が48個あること、また、この数がヒトゲノム解読の結果を待っても変わっていないことは、核内受容体研究が数年前である新しい段階に到達したことを意味している。かつてOrphanと見なされていた核内受容体の多くも、リガンドが発見されるようになり、機能の解明が進んでいる。また、X線結晶解析などにより、3次元構造が決定されたものも多くなっている。そして、すでに半数近くの核内受容体を標的とする薬が開発され、市場に登場している。
ゲノム解読の発展は、さまざまな後生動物に核内受容体が存在し、共通の機能を担っていることを教えている。こうした研究から、単細胞生物と推定されている、多細胞動物の共通の祖先生物の存在や、核内受容体とその共役因子の起源に関する推測もなされている。
基礎生物学、および医学の視点から見た時、共通の課題は、転写因子としての遺伝子発現調節機構の複雑さと、組織とタイミングへの依存性であろう。遺伝子発現機構を全ゲノムレベルで網羅的に明らかにすることは、ゲノム科学の次なる課題であり、また、核内受容体標的薬開発における焦眉の急というべき課題(Selective Nuclear Receptor Modulator研究)である。核内受容体研究の重要さと面白さは、このように基礎と応用が直結しているところにあると言える。